傳統觀點認為,大腸桿菌(Escherichia coli)缺乏完整的胞外呼吸(extracellular respiration)能力,因其基因組中未編碼典型的細胞色素c或Mtr型電子傳遞系統,而這些是其他微生物(如希瓦氏菌或地桿菌)進行胞外電子傳遞的關鍵元件。然而,近期研究表明,大腸桿菌可能在特定條件下激活這一代謝潛能。
為探究氧化還原穿梭體在細胞內的還原機制及其在細胞生物能學中的作用,研究人員開展了關于大腸桿菌(E. coli )介導的細胞外電子轉移(EET)機制和生物能學的研究。結果發現E. coli可利用 2 - 羥基 - 1,4 - 萘醌(HNQ)進行細胞外呼吸,還存在快速遺傳適應。這揭示了一種新的厭氧能量代謝類型。
研究人員構建了缺乏發酵途徑關鍵基因(如乳酸脫氫酶)的突變菌株,迫使其依賴替代能量代謝途徑。通過電化學分析、轉錄組測序及代謝物檢測,團隊系統評估了菌株的電子傳遞效率與能量代謝模式。
 圖1 細胞外呼吸是大腸桿菌的一種潛在能量代謝
圖1 細胞外呼吸是大腸桿菌的一種潛在能量代謝大腸桿菌(E. coli)能利用 2 - 羥基 - 1,4 - 萘醌(HNQ)進行高效的細胞外呼吸;HNQ 介導的大腸桿菌細胞外電子轉移(EET)由硝基還原酶 NfsB 和 NfsA 促進;細胞外呼吸比發酵具有顯著的生物能優勢;短期適應導致了 OmpC 突變,使大腸桿菌能夠在陽極上生長。總結:多種微生物利用氧化還原穿梭體,通過介導的細胞外電子轉移(EET)與環境交換電子,以支持厭氧生存。盡管介導的 EET 已用于生物電催化數十年,但關于這些氧化還原穿梭體在細胞內如何被還原以及它們在細胞生物能學中的作用仍存在基本問題。在這里,研究人員整合基因組編輯、電化學和系統生物學方法,研究大腸桿菌(E. coli)中介導的 EET 的機制和生物能學,這一問題二十多年來一直未得到解答。在沒有其他電子受體的情況下,通過細胞質硝基還原酶 NfsB 和 NfsA 對 2 - 羥基 - 1,4 - 萘醌(HNQ)進行氧化還原循環,使大腸桿菌能夠在細胞外電極上進行呼吸。大腸桿菌在外膜孔蛋白 OmpC 上也表現出快速的遺傳適應,增強了與生長相關的 HNQ 介導的 EET 水平。這項工作表明,大腸桿菌可以獨立于經典的電子傳遞鏈和發酵進行生長,揭示了一種可能廣泛存在的新型厭氧能量代謝。
關鍵發現
電子傳遞鏈的重構:進化后的大腸桿菌通過上調內膜醌氧化酶(如CyoABCD)和利用外膜c型細胞色素(如MtrC同源蛋白)形成簡化但功能性的電子傳遞鏈,將電子從胞內傳遞至胞外受體。
能量效率對比:相較于發酵作用,胞外呼吸產生的ATP效率較低,但在碳源受限時顯示出生存優勢,表明其作為"能量備用策略"的適應性意義。
基因表達可塑性:研究揭示了非經典呼吸相關基因(如cyoABCD、mtrA)的動態調控網絡,暗示大腸桿菌代謝網絡的隱性進化潛力。
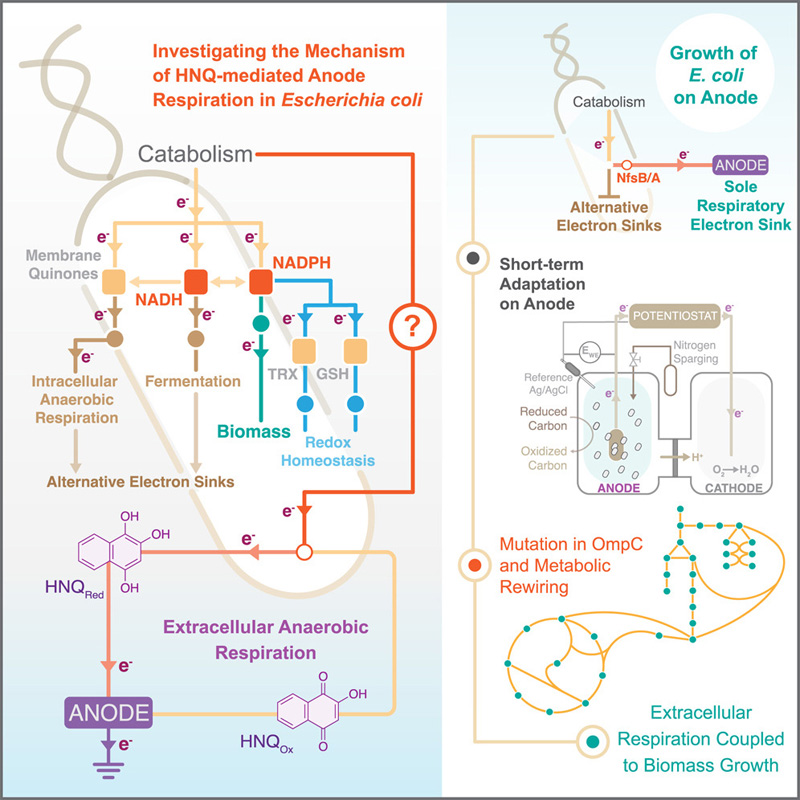
圖2 HNQ介導的大腸桿菌陽極呼吸機制的研究
該研究挑戰了對大腸桿菌代謝能力的傳統認知,為合成生物學改造提供了新方向。例如,工程化的大腸桿菌或可用于微生物燃料電池、環境污染物修復(如還原重金屬)及新型生物制造平臺。此外,研究強調了微生物代謝冗余在環境適應中的重要性,為理解細菌代謝進化提供了理論框架。
作者建議進一步解析電子傳遞的分子機制,并通過理性設計優化菌株的胞外呼吸效率。同時,探索其他"非模式微生物"中類似隱性代謝途徑的存在性,可能為微生物能源技術開辟新路徑。
參考資料
[1] Extracellular respiration is a latent energy metabolism in Escherichia coli
傳統觀點認為,大腸桿菌(Escherichia coli)缺乏完整的胞外呼吸(extracellular respiration)能力,因其基因組中未編碼典型的細胞色素c或Mtr型電子傳遞系統,而這些是其他微生物(如希瓦氏菌或地桿菌)進行胞外電子傳遞的關鍵元件。然而,近期研究表明,大腸桿菌可能在特定條件下激活這一代謝潛能。
為探究氧化還原穿梭體在細胞內的還原機制及其在細胞生物能學中的作用,研究人員開展了關于大腸桿菌(E. coli )介導的細胞外電子轉移(EET)機制和生物能學的研究。結果發現E. coli可利用 2 - 羥基 - 1,4 - 萘醌(HNQ)進行細胞外呼吸,還存在快速遺傳適應。這揭示了一種新的厭氧能量代謝類型。
研究人員構建了缺乏發酵途徑關鍵基因(如乳酸脫氫酶)的突變菌株,迫使其依賴替代能量代謝途徑。通過電化學分析、轉錄組測序及代謝物檢測,團隊系統評估了菌株的電子傳遞效率與能量代謝模式。
 圖1 細胞外呼吸是大腸桿菌的一種潛在能量代謝
圖1 細胞外呼吸是大腸桿菌的一種潛在能量代謝大腸桿菌(E. coli)能利用 2 - 羥基 - 1,4 - 萘醌(HNQ)進行高效的細胞外呼吸;HNQ 介導的大腸桿菌細胞外電子轉移(EET)由硝基還原酶 NfsB 和 NfsA 促進;細胞外呼吸比發酵具有顯著的生物能優勢;短期適應導致了 OmpC 突變,使大腸桿菌能夠在陽極上生長。總結:多種微生物利用氧化還原穿梭體,通過介導的細胞外電子轉移(EET)與環境交換電子,以支持厭氧生存。盡管介導的 EET 已用于生物電催化數十年,但關于這些氧化還原穿梭體在細胞內如何被還原以及它們在細胞生物能學中的作用仍存在基本問題。在這里,研究人員整合基因組編輯、電化學和系統生物學方法,研究大腸桿菌(E. coli)中介導的 EET 的機制和生物能學,這一問題二十多年來一直未得到解答。在沒有其他電子受體的情況下,通過細胞質硝基還原酶 NfsB 和 NfsA 對 2 - 羥基 - 1,4 - 萘醌(HNQ)進行氧化還原循環,使大腸桿菌能夠在細胞外電極上進行呼吸。大腸桿菌在外膜孔蛋白 OmpC 上也表現出快速的遺傳適應,增強了與生長相關的 HNQ 介導的 EET 水平。這項工作表明,大腸桿菌可以獨立于經典的電子傳遞鏈和發酵進行生長,揭示了一種可能廣泛存在的新型厭氧能量代謝。
關鍵發現
電子傳遞鏈的重構:進化后的大腸桿菌通過上調內膜醌氧化酶(如CyoABCD)和利用外膜c型細胞色素(如MtrC同源蛋白)形成簡化但功能性的電子傳遞鏈,將電子從胞內傳遞至胞外受體。
能量效率對比:相較于發酵作用,胞外呼吸產生的ATP效率較低,但在碳源受限時顯示出生存優勢,表明其作為"能量備用策略"的適應性意義。
基因表達可塑性:研究揭示了非經典呼吸相關基因(如cyoABCD、mtrA)的動態調控網絡,暗示大腸桿菌代謝網絡的隱性進化潛力。

圖2 HNQ介導的大腸桿菌陽極呼吸機制的研究
該研究挑戰了對大腸桿菌代謝能力的傳統認知,為合成生物學改造提供了新方向。例如,工程化的大腸桿菌或可用于微生物燃料電池、環境污染物修復(如還原重金屬)及新型生物制造平臺。此外,研究強調了微生物代謝冗余在環境適應中的重要性,為理解細菌代謝進化提供了理論框架。
作者建議進一步解析電子傳遞的分子機制,并通過理性設計優化菌株的胞外呼吸效率。同時,探索其他"非模式微生物"中類似隱性代謝途徑的存在性,可能為微生物能源技術開辟新路徑。
參考資料
[1] Extracellular respiration is a latent energy metabolism in Escherichia coli



