摘要:研究人員詳細(xì)描述了炎癥信號(hào)分子IL-12導(dǎo)致阿爾茨海默病的確切機(jī)制。
研究人員來(lái)自柏林夏里特醫(yī)學(xué)院和馬克斯·德?tīng)柌紖慰酥行?,他們?cè)敿?xì)揭示了炎癥信號(hào)分子IL-12如何導(dǎo)致阿爾茨海默病的精確機(jī)制。該研究發(fā)表在《自然·衰老》雜志上。
大腦的免疫細(xì)胞——小膠質(zhì)細(xì)胞,通常充當(dāng)著盡職盡責(zé)的守護(hù)者。它們清除入侵者,如微生物,并清理細(xì)胞碎片——包括阿爾茨海默病特有的斑塊。然而,隨著大腦的衰老,小膠質(zhì)細(xì)胞也會(huì)發(fā)生變化。雖然有些仍然能夠有效發(fā)揮作用,但另一些會(huì)逐漸失去保護(hù)作用,并開(kāi)始分泌少量炎癥信號(hào)分子。
 圖1 白細(xì)胞介素-12信號(hào)通路通過(guò)破壞神經(jīng)元與少突膠質(zhì)細(xì)胞穩(wěn)態(tài)驅(qū)動(dòng)阿爾茨海默病病理進(jìn)程
圖1 白細(xì)胞介素-12信號(hào)通路通過(guò)破壞神經(jīng)元與少突膠質(zhì)細(xì)胞穩(wěn)態(tài)驅(qū)動(dòng)阿爾茨海默病病理進(jìn)程其中一種信號(hào)分子就是白細(xì)胞介素-12(IL-12)。通過(guò)細(xì)致的分析,由柏林夏里特醫(yī)學(xué)院神經(jīng)病理學(xué)系主任弗蘭克·赫普納教授和馬克斯·德?tīng)柌紖慰酥行陌亓轴t(yī)學(xué)系統(tǒng)生物學(xué)研究所所長(zhǎng)尼古拉·拉耶夫斯基教授領(lǐng)導(dǎo)的研究團(tuán)隊(duì),以及他們的合作伙伴,識(shí)別出IL-12如何觸發(fā)并加速阿爾茨海默病癡呆。他們的研究發(fā)表在《自然·衰老》上,可能會(huì)為新的聯(lián)合療法鋪平道路。
“數(shù)十年來(lái),阿爾茨海默病的研究幾乎只專注于淀粉樣蛋白β和tau蛋白沉積,而炎癥被認(rèn)為是一種副作用。”赫普納說(shuō),“直到最近,我們才開(kāi)始認(rèn)識(shí)到炎癥過(guò)程可能是疾病進(jìn)展的主要驅(qū)動(dòng)力?!?012年,赫普納的實(shí)驗(yàn)室在《自然·醫(yī)學(xué)》雜志上報(bào)告稱,阻斷IL-12和IL-23顯著減少了小鼠大腦中與阿爾茨海默病相關(guān)的改變?!暗覀儫o(wú)法用標(biāo)準(zhǔn)技術(shù)解開(kāi)其背后的機(jī)制。”赫普納解釋道。他認(rèn)為單細(xì)胞分析可能會(huì)提供更關(guān)鍵的線索,于是邀請(qǐng)拉耶夫斯基合作。
細(xì)胞在一生中會(huì)參考其遺傳指令來(lái)對(duì)外部刺激做出反應(yīng)。研究人員利用單細(xì)胞分析來(lái)觀察這一過(guò)程,同時(shí)重建數(shù)千個(gè)單細(xì)胞中正在被讀取并轉(zhuǎn)化為蛋白質(zhì)的基因。這些分析產(chǎn)生了海量數(shù)據(jù)集,如今可以借助人工智能和機(jī)器學(xué)習(xí)進(jìn)行分析。然而,使用單細(xì)胞測(cè)序技術(shù)的一個(gè)主要挑戰(zhàn)是從組織樣本中分離單個(gè)細(xì)胞,而不損傷它們或?qū)е乱馔庾兓??!霸谒ダ系男∈蟠竽X中——尤其是那些有阿爾茨海默病斑塊的大腦——細(xì)胞緊密相連且糾纏不清,幾乎無(wú)法干凈地分離它們?!崩蛩够忉尩馈?/div> 圖1 白細(xì)胞介素-12信號(hào)通路通過(guò)破壞神經(jīng)元與少突膠質(zhì)細(xì)胞穩(wěn)態(tài)驅(qū)動(dòng)阿爾茨海默病病理進(jìn)程
圖1 白細(xì)胞介素-12信號(hào)通路通過(guò)破壞神經(jīng)元與少突膠質(zhì)細(xì)胞穩(wěn)態(tài)驅(qū)動(dòng)阿爾茨海默病病理進(jìn)程
他的團(tuán)隊(duì)花了數(shù)年時(shí)間完善了一種變通方法。他們沒(méi)有分離整個(gè)細(xì)胞,而是從大腦組織中提取細(xì)胞核,并分析每個(gè)細(xì)胞中的RNA。通過(guò)與公開(kāi)數(shù)據(jù)(如艾倫大腦圖譜)進(jìn)行交叉比對(duì),他們可以確保其方法能夠提供所有細(xì)胞群體的代表性快照。在本研究中,他們對(duì)超過(guò)8萬(wàn)個(gè)細(xì)胞核的RNA進(jìn)行了測(cè)序,并開(kāi)發(fā)了專門的工作流程來(lái)處理數(shù)據(jù)。他們還重建了細(xì)胞之間的通信?!拔覀兊膱F(tuán)隊(duì)多次坐在一起試圖解讀這些極其復(fù)雜的數(shù)據(jù)?!崩蛩够f(shuō),“這種早期的精心優(yōu)化至關(guān)重要——沒(méi)有它,我們無(wú)法檢測(cè)到這些聯(lián)系?!?/div>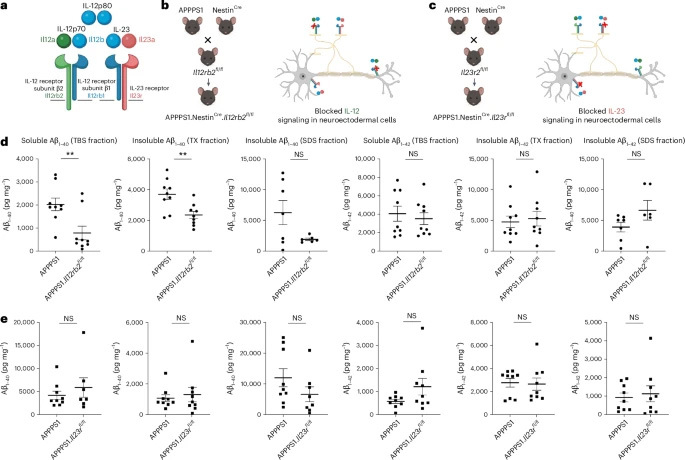
圖2 敲除IL-12特異性受體亞基IL12Rβ2可減少淀粉樣蛋白沉積負(fù)荷
白細(xì)胞介素-12(IL-12)此前主要以其在克羅恩病和類風(fēng)濕關(guān)節(jié)炎等自身免疫疾病中的作用而聞名,現(xiàn)在看來(lái)它在阿爾茨海默病的進(jìn)展中也發(fā)揮著關(guān)鍵作用。它會(huì)損害兩種關(guān)鍵的腦細(xì)胞類型:成熟的少突膠質(zhì)細(xì)胞,它們通常產(chǎn)生髓鞘——圍繞神經(jīng)纖維的脂肪絕緣層,對(duì)快速信號(hào)傳導(dǎo)至關(guān)重要;以及中間神經(jīng)元,這些神經(jīng)元對(duì)認(rèn)知和記憶尤其重要。IL-12與中間神經(jīng)元結(jié)合會(huì)導(dǎo)致它們死亡。一個(gè)惡性循環(huán)開(kāi)始了:隨著越來(lái)越多的小膠質(zhì)細(xì)胞產(chǎn)生IL-12,越來(lái)越多的腦細(xì)胞受到損害。與此同時(shí),仍然能夠正常發(fā)揮功能的小膠質(zhì)細(xì)胞被清理額外細(xì)胞碎片的任務(wù)壓垮,因此無(wú)法清除阿爾茨海默病斑塊。

圖2 敲除IL-12特異性受體亞基IL12Rβ2可減少淀粉樣蛋白沉積負(fù)荷
為了驗(yàn)證這一機(jī)制,研究人員在小鼠和人類組織中進(jìn)行了測(cè)試。當(dāng)赫普納的團(tuán)隊(duì)在細(xì)胞培養(yǎng)和小鼠模型中阻斷IL-12時(shí),他們能夠阻止與疾病相關(guān)的改變。在哥廷根的馬普多學(xué)科科學(xué)研究所拍攝的小鼠大腦組織的電子顯微照片也顯示了髓鞘結(jié)構(gòu)和神經(jīng)纖維密度如何根據(jù)IL-12信號(hào)通路是否存在而發(fā)生變化。在蘇黎世大學(xué)進(jìn)行的質(zhì)譜分析(脂質(zhì)組學(xué))證實(shí)了脂肪絕緣層成分的改變。對(duì)阿爾茨海默病患者尸檢組織的研究進(jìn)一步證實(shí)了這些結(jié)果——疾病越嚴(yán)重,組織中IL-12的含量就越高。含有人類少突膠質(zhì)細(xì)胞的細(xì)胞培養(yǎng)對(duì)IL-12也非常敏感。
“我們現(xiàn)在對(duì)這一機(jī)制有了非常詳細(xì)的了解,單細(xì)胞技術(shù)是關(guān)鍵的催化劑。唯一剩下的問(wèn)題是IL-12首先影響哪種細(xì)胞類型——少突膠質(zhì)細(xì)胞、中間神經(jīng)元,還是兩者同時(shí)?”赫普納說(shuō),他也是德國(guó)神經(jīng)退行性疾病研究中心的神經(jīng)免疫學(xué)小組負(fù)責(zé)人。
該研究具有直接的臨床意義,因?yàn)橐呀?jīng)有藥物可以阻斷IL-12。研究人員希望臨床醫(yī)生能夠在此基礎(chǔ)上開(kāi)展臨床試驗(yàn)。“如果這些藥物被證明有效,它們將成為我們對(duì)抗阿爾茨海默病的新武器。阿爾茨海默病并非只有一個(gè)原因。疾病的一個(gè)軸至少在某些患者中由免疫系統(tǒng)控制。減緩神經(jīng)退行性變需要聯(lián)合療法?!焙掌占{強(qiáng)調(diào)。這種療法可以在疾病早期開(kāi)始,因?yàn)镮L-12可以在血液或腦脊液中檢測(cè)到。
與此同時(shí),夏里特和馬克斯·德?tīng)柌紖慰酥行牡膱F(tuán)隊(duì)正在探索一個(gè)新的假設(shè):大腦中的微塑料是否會(huì)導(dǎo)致小膠質(zhì)細(xì)胞產(chǎn)生IL-12?“小膠質(zhì)細(xì)胞可能難以處理微塑料,從而引發(fā)炎癥反應(yīng)。”拉耶夫斯基表示,“這可能會(huì)揭示環(huán)境因素與廣泛疾病之間的聯(lián)系?!北M管尚未得到證實(shí),但兩個(gè)團(tuán)隊(duì)都認(rèn)為這是一個(gè)引人入勝且重要的研究方向。
參考資料
[1] Interleukin-12 signaling drives Alzheimer’s disease pathology through disrupting neuronal and oligodendrocyte homeostasis
摘要:研究人員詳細(xì)描述了炎癥信號(hào)分子IL-12導(dǎo)致阿爾茨海默病的確切機(jī)制。
研究人員來(lái)自柏林夏里特醫(yī)學(xué)院和馬克斯·德?tīng)柌紖慰酥行?,他們?cè)敿?xì)揭示了炎癥信號(hào)分子IL-12如何導(dǎo)致阿爾茨海默病的精確機(jī)制。該研究發(fā)表在《自然·衰老》雜志上。
大腦的免疫細(xì)胞——小膠質(zhì)細(xì)胞,通常充當(dāng)著盡職盡責(zé)的守護(hù)者。它們清除入侵者,如微生物,并清理細(xì)胞碎片——包括阿爾茨海默病特有的斑塊。然而,隨著大腦的衰老,小膠質(zhì)細(xì)胞也會(huì)發(fā)生變化。雖然有些仍然能夠有效發(fā)揮作用,但另一些會(huì)逐漸失去保護(hù)作用,并開(kāi)始分泌少量炎癥信號(hào)分子。
 圖1 白細(xì)胞介素-12信號(hào)通路通過(guò)破壞神經(jīng)元與少突膠質(zhì)細(xì)胞穩(wěn)態(tài)驅(qū)動(dòng)阿爾茨海默病病理進(jìn)程
圖1 白細(xì)胞介素-12信號(hào)通路通過(guò)破壞神經(jīng)元與少突膠質(zhì)細(xì)胞穩(wěn)態(tài)驅(qū)動(dòng)阿爾茨海默病病理進(jìn)程其中一種信號(hào)分子就是白細(xì)胞介素-12(IL-12)。通過(guò)細(xì)致的分析,由柏林夏里特醫(yī)學(xué)院神經(jīng)病理學(xué)系主任弗蘭克·赫普納教授和馬克斯·德?tīng)柌紖慰酥行陌亓轴t(yī)學(xué)系統(tǒng)生物學(xué)研究所所長(zhǎng)尼古拉·拉耶夫斯基教授領(lǐng)導(dǎo)的研究團(tuán)隊(duì),以及他們的合作伙伴,識(shí)別出IL-12如何觸發(fā)并加速阿爾茨海默病癡呆。他們的研究發(fā)表在《自然·衰老》上,可能會(huì)為新的聯(lián)合療法鋪平道路。
“數(shù)十年來(lái),阿爾茨海默病的研究幾乎只專注于淀粉樣蛋白β和tau蛋白沉積,而炎癥被認(rèn)為是一種副作用。”赫普納說(shuō),“直到最近,我們才開(kāi)始認(rèn)識(shí)到炎癥過(guò)程可能是疾病進(jìn)展的主要驅(qū)動(dòng)力。”2012年,赫普納的實(shí)驗(yàn)室在《自然·醫(yī)學(xué)》雜志上報(bào)告稱,阻斷IL-12和IL-23顯著減少了小鼠大腦中與阿爾茨海默病相關(guān)的改變?!暗覀儫o(wú)法用標(biāo)準(zhǔn)技術(shù)解開(kāi)其背后的機(jī)制?!焙掌占{解釋道。他認(rèn)為單細(xì)胞分析可能會(huì)提供更關(guān)鍵的線索,于是邀請(qǐng)拉耶夫斯基合作。
細(xì)胞在一生中會(huì)參考其遺傳指令來(lái)對(duì)外部刺激做出反應(yīng)。研究人員利用單細(xì)胞分析來(lái)觀察這一過(guò)程,同時(shí)重建數(shù)千個(gè)單細(xì)胞中正在被讀取并轉(zhuǎn)化為蛋白質(zhì)的基因。這些分析產(chǎn)生了海量數(shù)據(jù)集,如今可以借助人工智能和機(jī)器學(xué)習(xí)進(jìn)行分析。然而,使用單細(xì)胞測(cè)序技術(shù)的一個(gè)主要挑戰(zhàn)是從組織樣本中分離單個(gè)細(xì)胞,而不損傷它們或?qū)е乱馔庾兓?。“在衰老的小鼠大腦中——尤其是那些有阿爾茨海默病斑塊的大腦——細(xì)胞緊密相連且糾纏不清,幾乎無(wú)法干凈地分離它們?!崩蛩够忉尩?。
他的團(tuán)隊(duì)花了數(shù)年時(shí)間完善了一種變通方法。他們沒(méi)有分離整個(gè)細(xì)胞,而是從大腦組織中提取細(xì)胞核,并分析每個(gè)細(xì)胞中的RNA。通過(guò)與公開(kāi)數(shù)據(jù)(如艾倫大腦圖譜)進(jìn)行交叉比對(duì),他們可以確保其方法能夠提供所有細(xì)胞群體的代表性快照。在本研究中,他們對(duì)超過(guò)8萬(wàn)個(gè)細(xì)胞核的RNA進(jìn)行了測(cè)序,并開(kāi)發(fā)了專門的工作流程來(lái)處理數(shù)據(jù)。他們還重建了細(xì)胞之間的通信。“我們的團(tuán)隊(duì)多次坐在一起試圖解讀這些極其復(fù)雜的數(shù)據(jù)?!崩蛩够f(shuō),“這種早期的精心優(yōu)化至關(guān)重要——沒(méi)有它,我們無(wú)法檢測(cè)到這些聯(lián)系?!?/div>
圖2 敲除IL-12特異性受體亞基IL12Rβ2可減少淀粉樣蛋白沉積負(fù)荷
白細(xì)胞介素-12(IL-12)此前主要以其在克羅恩病和類風(fēng)濕關(guān)節(jié)炎等自身免疫疾病中的作用而聞名,現(xiàn)在看來(lái)它在阿爾茨海默病的進(jìn)展中也發(fā)揮著關(guān)鍵作用。它會(huì)損害兩種關(guān)鍵的腦細(xì)胞類型:成熟的少突膠質(zhì)細(xì)胞,它們通常產(chǎn)生髓鞘——圍繞神經(jīng)纖維的脂肪絕緣層,對(duì)快速信號(hào)傳導(dǎo)至關(guān)重要;以及中間神經(jīng)元,這些神經(jīng)元對(duì)認(rèn)知和記憶尤其重要。IL-12與中間神經(jīng)元結(jié)合會(huì)導(dǎo)致它們死亡。一個(gè)惡性循環(huán)開(kāi)始了:隨著越來(lái)越多的小膠質(zhì)細(xì)胞產(chǎn)生IL-12,越來(lái)越多的腦細(xì)胞受到損害。與此同時(shí),仍然能夠正常發(fā)揮功能的小膠質(zhì)細(xì)胞被清理額外細(xì)胞碎片的任務(wù)壓垮,因此無(wú)法清除阿爾茨海默病斑塊。

圖2 敲除IL-12特異性受體亞基IL12Rβ2可減少淀粉樣蛋白沉積負(fù)荷
為了驗(yàn)證這一機(jī)制,研究人員在小鼠和人類組織中進(jìn)行了測(cè)試。當(dāng)赫普納的團(tuán)隊(duì)在細(xì)胞培養(yǎng)和小鼠模型中阻斷IL-12時(shí),他們能夠阻止與疾病相關(guān)的改變。在哥廷根的馬普多學(xué)科科學(xué)研究所拍攝的小鼠大腦組織的電子顯微照片也顯示了髓鞘結(jié)構(gòu)和神經(jīng)纖維密度如何根據(jù)IL-12信號(hào)通路是否存在而發(fā)生變化。在蘇黎世大學(xué)進(jìn)行的質(zhì)譜分析(脂質(zhì)組學(xué))證實(shí)了脂肪絕緣層成分的改變。對(duì)阿爾茨海默病患者尸檢組織的研究進(jìn)一步證實(shí)了這些結(jié)果——疾病越嚴(yán)重,組織中IL-12的含量就越高。含有人類少突膠質(zhì)細(xì)胞的細(xì)胞培養(yǎng)對(duì)IL-12也非常敏感。
“我們現(xiàn)在對(duì)這一機(jī)制有了非常詳細(xì)的了解,單細(xì)胞技術(shù)是關(guān)鍵的催化劑。唯一剩下的問(wèn)題是IL-12首先影響哪種細(xì)胞類型——少突膠質(zhì)細(xì)胞、中間神經(jīng)元,還是兩者同時(shí)?”赫普納說(shuō),他也是德國(guó)神經(jīng)退行性疾病研究中心的神經(jīng)免疫學(xué)小組負(fù)責(zé)人。
該研究具有直接的臨床意義,因?yàn)橐呀?jīng)有藥物可以阻斷IL-12。研究人員希望臨床醫(yī)生能夠在此基礎(chǔ)上開(kāi)展臨床試驗(yàn)。“如果這些藥物被證明有效,它們將成為我們對(duì)抗阿爾茨海默病的新武器。阿爾茨海默病并非只有一個(gè)原因。疾病的一個(gè)軸至少在某些患者中由免疫系統(tǒng)控制。減緩神經(jīng)退行性變需要聯(lián)合療法?!焙掌占{強(qiáng)調(diào)。這種療法可以在疾病早期開(kāi)始,因?yàn)镮L-12可以在血液或腦脊液中檢測(cè)到。
與此同時(shí),夏里特和馬克斯·德?tīng)柌紖慰酥行牡膱F(tuán)隊(duì)正在探索一個(gè)新的假設(shè):大腦中的微塑料是否會(huì)導(dǎo)致小膠質(zhì)細(xì)胞產(chǎn)生IL-12?“小膠質(zhì)細(xì)胞可能難以處理微塑料,從而引發(fā)炎癥反應(yīng)?!崩蛩够硎?,“這可能會(huì)揭示環(huán)境因素與廣泛疾病之間的聯(lián)系。”盡管尚未得到證實(shí),但兩個(gè)團(tuán)隊(duì)都認(rèn)為這是一個(gè)引人入勝且重要的研究方向。
參考資料
[1] Interleukin-12 signaling drives Alzheimer’s disease pathology through disrupting neuronal and oligodendrocyte homeostasis



